-
- 해외인허가
- NAMSA는 미국FDA, 일본 PMDA, 유럽 Notified Body, 중국 NMPA 외에도 기타 규제당국과의 원활하고 효과적인 소통을 통해 성공적인 규제 인허가와 성과를 이끌어내는 선두 기업입니다.
-
- 의료기기 생물학적 안전성 시험
- NAMSA는 의료기기 시험분야의 선구자이며, 오늘날에도 안정되고 검증된 의료기기 시험서비스를 제공하며 업계리더로서 활동하고 있습니다.
-
- 해외임상시험
- 글로벌 의료기기 분야는 매우 복잡하여 신제품이나 신기술에 대한 승인을 받기 위해서는 설득력 있는 임상 근거가 필요합니다. NAMSA에서는 이러한 장벽에 대한 이해를 바탕으로 고객의 성공을 위한 임상서비스를 제공합니다.
-
- 제품 개발 전략 컨설팅
- NAMSA의 제품 개발 전략 서비스는 제품 컨셉에서부터 시판 후 관리까지 고객이 제품개발과정과 치료분야, 보험, 규제 환경에서 겪는 어려움들에 대한 솔루션을 제공합니다.
-
- IVD
- NAMSA는 CRO 중 유일하게 IVD 사업부를 독립적으로 운영하고 있으며 IVD 제조사 고유의 제품개발 요구에 집중합니다.
-
- NAMSA APEX PROGRAM™
- NAMSA의 APEX 프로그램은 의료기기의 성공적인 규제승인 및 제품채택을 위해 예측 가능한 제품개발지원 프로그램을 제공합니다.
NAMSA SERVICE
NAMSA OFFERS ONLY THE MOST PROVEN
STRATEGIES & SOLUTIONS THAT HELP TRANSLATE
GREAT IDEAS INTO GREAT MEDICAL PRODUCTS
- 해외인허가
- 고객의 신속한 글로벌 진출 지원이 입증된 인허가 전략
미팅 관리
SERVICE
- Biological Safety & Validation Consulting
- FDA U.S. Agent Services
- International Medical Device Registration
- Consulting
- Medical Writing
- Quality Systems & Compliance
NAMSA는 미국FDA, 일본 PMDA, 유럽 Notified Body, 중국 NMPA 외에도 기타 규제당국과의 원활하고 효과적인 소통을 통해 성공적인 규제 인허가와 성과를 이끌어내는 선두 기업입니다.
NAMSA에서 일하는 많은 전문가들은 FDA, Notified Body등의 근무경험을 통해 국제 요구 사항 및 기준에 대한 사전 계획을 수립하는 방법에 대해 명확하게 이해합니다.
이러한 경험과 이해를 바탕으로 고객사의 제품 을 신속하게 출시하여 궁극적으로 환자 안전 및 의료에 보다 빠른 영향을 미칠 수 있도록 노력합니다.

서비스에 대한 보다 자세한 내용은 NAMSA 글로벌 웹사이트 (인허가)를 방문해주세요. 바로가기
- 의료기기 생물학적 안전성 시험
- NAMSA는 의료기기 시험분야의 선구자이며, 오늘날에도 안정되고 검증된 의료기기 시험서비스를 제공하며 업계리더로서 활동하고 있습니다.
SERVICE
- Biocompatibility testing
- Biological Safety
- Chemical Characterization & Analytical Chemistry
- Cleaning Studies & New Single Use Devices
- Environmental Monitoring
- Histopathology
- Long-term & Accelerated Shelf Life Testing (ICH)
- Method Development & Validation
- Packaging Validation Services
- Particulate Analysis
- Physician Training
- Preclinical and Interventional/Surgical Research
- Sterilization Validation
- Validation for Reprocessed Medical Devices
- Other Microbiology Testing Services
서비스에 대한 보다 자세한 내용은 NAMSA 글로벌 웹사이트 (의료기기 시험)를 방문해주세요. 바로가기
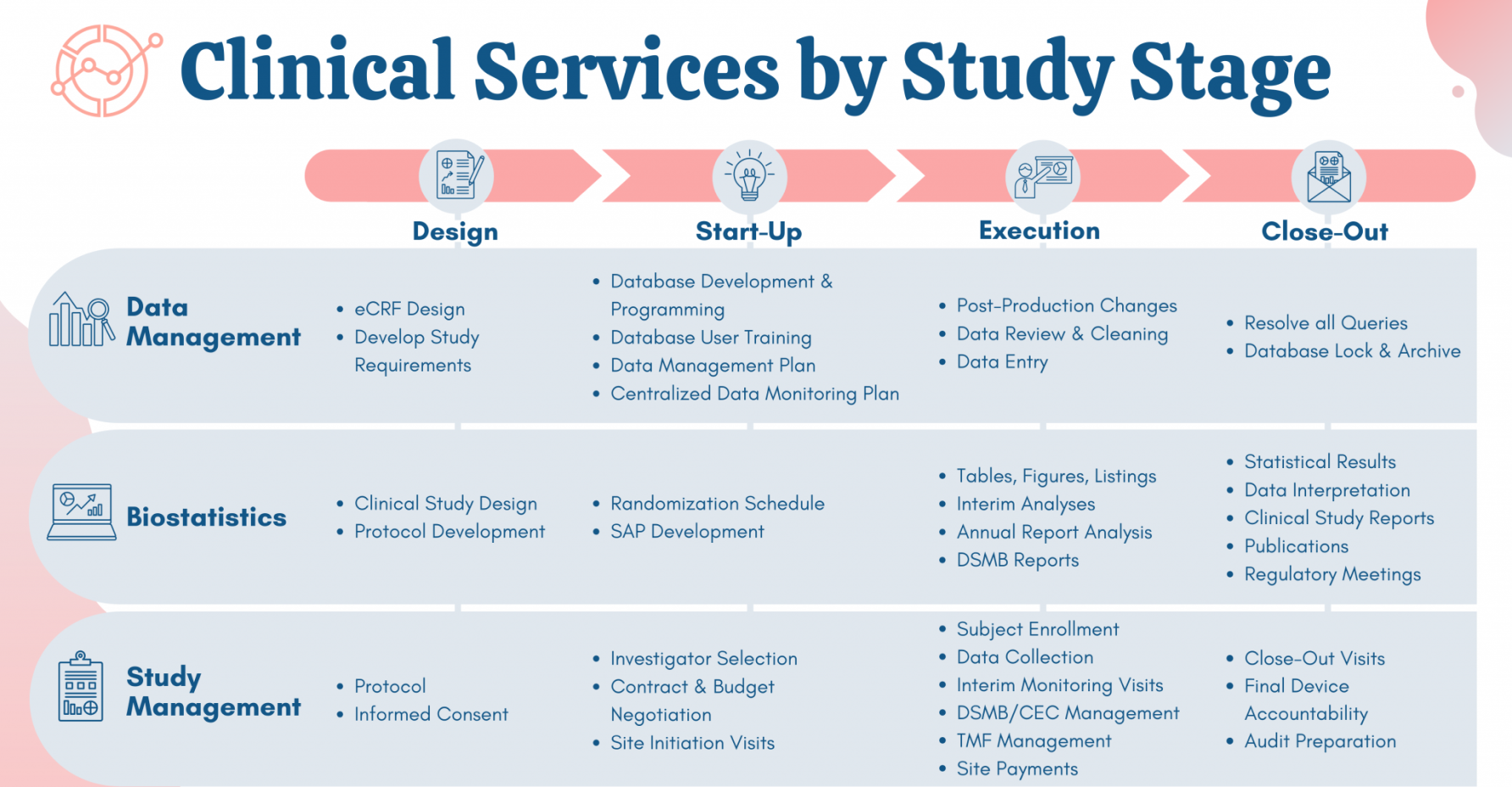
- 해외임상시험
- 고객맞춤형 통합서비스를 제공합니다.
프로젝트 시행
100% 집중연구
임상시험 지원
SERVICE
- Biostatistics & Statistical Programming
- Clinical Evidence & Post-Market Studies
- Clinical Study Management
- Clinical Trial Safety
- Data Management
- Field Clinical Engineering Staffing
- Safety Reporting & Clinical Events Committees
서비스에 대한 보다 자세한 내용은 NAMSA 글로벌 웹사이트 (임상시험)를 방문해주세요. 바로가기
- 제품 개발 전략 컨설팅
- 제품 컨셉에서부터 시판 후 관리까지 제품개발과정과 치료분야, 보험, 규제 환경에서 겪는 어려움들에 대한 솔루션을 제공합니다.
규제기관 및 관련 기관 경험
의료기기 산업 경험
미팅 관리
ARE YOU?
- 자원과 재정에 부담을 느끼는 스타트업 기업이십니까?
- 제품 전 임상시험의 전반적인 전략에 대한 전문 지식이 필요하십니까?
- 직원을 채용하고 교육하는 데에는 시간이 필요한데 당장 전문가의 도움이 필요하십니까?
- 제품개발에 필요한 기간, 비용 감축을 통해 제품 출시 전 자금고갈(burn rate)에 대한 부담을 줄일 방법을 찾고 계십니까?
NAMSA의 PDS(제품개발전략) 전문가들은 제품의 개발 장애요소들과 위험부담을 줄이기 위해 모든 이해관계자들과 어떻게
소통해야 하는지 이해하며, 귀사의 팀원과 같은 마음으로 서비스를 제공합니다.
고객의 시간과 비용을 절감하면서도 안전하고 효과적으로 타깃시장에 신속하게 진입하는 방법에 대해 가이드를 제공합니다.
SERVICE
- 규제 전략 컨설팅
- 제품 개발 탐색 세션
- 제품 개발 GET-TO-MARKET 전략
- 제품 개발 전략 실행 (MRO 프로그램)

서비스에 대한 보다 자세한 내용은 NAMSA 글로벌 웹사이트 (제품개발전략)를 방문해주세요. 바로가기
- IVD
- IVD 제조사 고유의 제품개발 요구에 집중합니다.
SERVICE
- IVD Regulatory Services
- IVD Reimbursement Support Services
- IVD Quality Systems Services
- IVD Therapeutic Expertise
- IVD Clinical Research, Biostatistics & Data Management Service
- IVD Client Testimonials
NAMSA는 CRO 중 유일하게 IVD 사업부를 독립적으로 운영하고 있으며 IVD 제조사 고유의 제품개발 요구에 집중합니다. 당사는 고객이 IVD 요구 사항에 대한 사전 예방적 접근 과 심층적인 지식을 통해 삶을 변화시키는 IVD 제품의 상용화를 빠르게 추적할 수 있도록 지원합니다.
당사는 IVD 요구사항에 대한 사전 예방적 접근과 심층적인 전문지식을 통해 혁신적인 IVD제품이 신속하게 상용화될 수 있도록합니다.
IVD 규제 평가 및 인허가 지원, IVDR 준수 기술 파일 개발, 임상 시험 설계 및 관리 또는 ISO 13485:2016 및 21 CFR part 820 준수 품질 시스템 구축 등 IVD 규제전략에 대한 모든 것을 지원합니다.
서비스에 대한 보다 자세한 내용은 NAMSA 글로벌 웹사이트 (IVD)를 방문해주세요. 바로가기
- NAMSA APEX PROGRAM™
- 신속한 제품 상용화를 위한 입증된 개발 전략 지원
SERVICE
의료기기 개발은 복합적인 과정입니다. 또한, 오늘날 가치기반(value-based)제도의 도입으로 규제승인이 완료된 제품이 반드시 시장에 채택되는 것은 아닙니다. 이러한 리스크를 최소화하고 효율적인 규제전략을 통해 상업적 성공을 높이기 위해서는 다양한 요인과 이해관계자를 고려한 통합전략이 필요합니다.
NAMSA APEX Program™은 이와 같은 목표를 고려하여 설계되었습니다. MedTech 업계 최상위 분야전문가(SME, Subject Matter Expert), 각 제품개발단계별 계획 예측, 효율적인 프로젝트 기간수립 등 NAMSA의 검증된 통합 서비스 및 도구 등을 통해 귀사의 제품개발목표를 달성할 수 있도록 지원합니다. 이는 궁극적으로 제품개발 기간을 현저하게 단축시키고 비용을 절감하는데 기여합니다.

서비스에 대한 보다 자세한 내용은 NAMSA 글로벌 웹사이트 (APEX PROGRAM)를 방문해주세요. 바로가기




